Un contrat a été passé avec la Commission, alors même que le laboratoire Gilead connaissait les résultats négatifs d’un essai clinique de l’OMS. La France est le seul pays majeur à ne pas avoir passé commande.
Comment en est-on arrivé à acheter partout sur la planète, à prix d’or, un médicament contre le Covid-19 dont l’efficacité n’est pas avérée ? C’est l’histoire du remdésivir, une molécule mise au point par le laboratoire américain Gilead, d’abord présentée comme un traitement miracle capable de perturber la réplication du virus, et finalement discréditée par un vaste essai clinique piloté par l’Organisation mondiale de la santé (OMS) dans trente pays, dont la France.
Baptisée Solidarity, cette étude, lancée en février, devait évaluer l’efficacité du remdésivir contre le SARS-CoV-2, et la comparer avec celle de trois autres molécules, dont l’hydroxychloroquine. Les résultats publiés le 15 octobre montrent que l’antiviral n’a aucun effet sur les malades. Le 20 novembre, l’OMS finit même par en déconseiller l’utilisation, soulignant « la possibilité d’importants effets secondaires », notamment sur les reins, son coût important et ses implications logistiques (il doit être administré par intraveineuse).
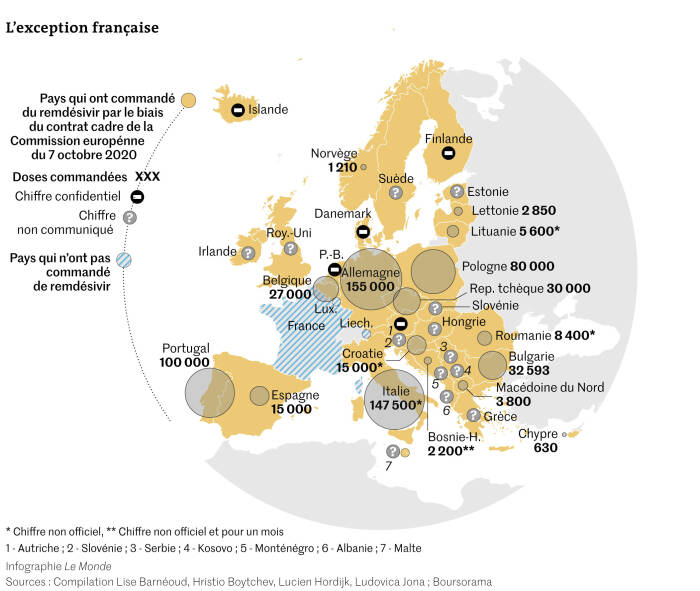
Mais l’avertissement arrive trop tard : des dizaines de pays − notamment européens − ont déjà passé commande. La France fait figure d’exception, seul grand pays à ne pas avoir acheté de doses dans le cadre d’un vaste contrat européen.
Comment Gilead, qui a réalisé plus de 22 milliards de dollars (18,5 milliards d’euros) de chiffres d’affaires en 2019 grâce à ses médicaments contre le VIH et l’hépatite C, a-t-il réussi un tel tour de passe-passe ? Retour sur une stratégie scientifique et commerciale parfaitement orchestrée, qui a déjà permis au laboratoire américain d’empocher près de 900 millions de dollars à travers le monde.
« De nombreux manques »
Testé sans grand succès contre Ebola, le remdésivir a été opportunément repositionné au début de l’épidémie de Covid-19, sur la base d’études antérieures avec d’autres coronavirus (SARS-CoV-1 et MERS-CoV). Gilead n’a pas grand-chose à perdre : il ne sait que faire des doses qu’il n’a pas utilisées lors des essais cliniques menés en Afrique.
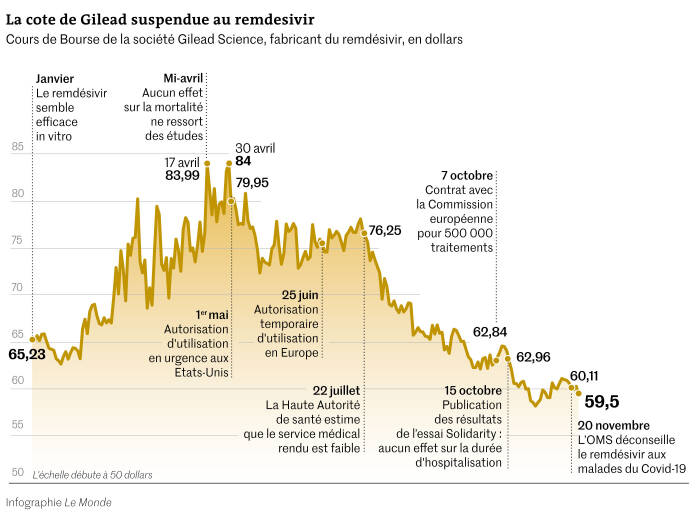
Le 6 février, un petit essai est lancé avec 237 patients recrutés dans les hôpitaux de Wuhan, foyer chinois de l’épidémie. L’espoir est immense, alors que la ville est déjà confinée depuis deux semaines, mais les résultats sont loin d’être à la hauteur : publiés en avril dans la prestigieuse revue scientifique The Lancet, ils ne montrent aucune efficacité sur la mortalité.
Le cours de Gilead perd quelques points sur les indices boursiers, mais le laboratoire américain ne se décourage pas. Un essai de plus grande ampleur − un millier de patients − a été lancé en février aux Etats-Unis : Gilead compte dessus pour convaincre la FDA, l’agence américaine du médicament. Un peu ébranlé par les résultats chinois, le laboratoire modifie cependant son critère d’efficacité principal : ce ne sera plus la mortalité, mais la « durée de récupération ».
Fin avril, des résultats intermédiaires sont rendus publics : l’essai ne montre aucune différence sur la mortalité, mais les patients avec une maladie sévère récupèrent en moyenne en dix jours avec du remdésivir, contre quinze dans le groupe placebo. C’est ce résultat qui pousse la FDA à délivrer une autorisation d’urgence de mise sur le marché du remdésivir, commercialisé sous la marque Veklury, le 1er mai. Deux jours plus tard, Daniel O’Day, le PDG de Gilead, annonce « donner » la totalité de son stock aux patients américains, soit 1,5 million de doses à l’époque.
L’EMA, l’agence européenne des médicaments, lui emboîte le pas et donne son feu vert pour commercialiser l’antiviral le 25 juin : il s’agit d’une autorisation de mise sur le marché « conditionnelle », avec une indication limitée aux patients avec pneumonie nécessitant une oxygénothérapie. « Même conditionnelle, avec réévaluation dans un an, cette autorisation supprime l’incitation principale de la firme à mieux évaluer ce médicament sur les critères majeurs que sont les gestes de réanimation et la mortalité », critique la revue médicale indépendante Prescrire, qui pointe « de nombreux manques dans les données fournies par la firme ».
« Maximiser son profit »
Une fois ces deux sésames décrochés, Gilead, connu comme l’un des négociateurs les plus intraitables de l’industrie, annonce fin juin son prix : 390 dollars la dose, soit 2 340 dollars (1 970 euros) le traitement, recommandé en six doses. « Une sortie plus rapide de l’hôpital permettrait de faire une économie d’environ 12 000 dollars par patient, calcule la firme, en s’appuyant sur les données américaines. Nous avons décidé de fixer le prix du remdésivir bien en dessous de ce montant. »
En 2014, le laboratoire avait réalisé un calcul économique similaire pour lancer son traitement contre l’hépatite C, le sofosbuvir (sous le nom commercial Sovaldi), au prix de 84 000 dollars. Un rapport du Sénat américain avait dénoncé la stratégie marketing de Gilead, seulement destinée à « maximiser son profit ».
D’après les calculs d’une équipe de chercheurs anglais, américains et australiens, le coût total de fabrication du remdésivir se situe aux alentours de 0,93 dollar par dose, soit 5,58 dollars pour un traitement en six doses. Autrement dit, 420 fois moins cher que le prix fixé par Gilead. Par ailleurs, le développement du remdésivir a déjà bénéficié d’investissements publics, pour environ 70 millions de dollars, d’après les calculs du cercle de réflexion américain Public Citizen. Selon l’Institute for Clinical and Economic Review, une organisation américaine qui évalue la valeur des médicaments, le prix de Gilead n’est « raisonnablement rentable » que si un bénéfice existe sur la mortalité des patients. Ce qu’aucun essai clinique ne parviendra à mettre en évidence.
Qu’importe, le coup d’envoi est donné. Le 15 juillet, la France accorde une autorisation temporaire d’utilisation (ATU) au remdésivir. Dans la foulée, Gilead demande à la commission de la transparence de la Haute Autorité de santé (HAS) l’évaluation de son médicament en vue d’un remboursement.
Mais c’est là que les choses se corsent. « La commission a considéré que le service médical rendu était faible, explique Jean-Pierre Thierry, conseiller médical de France Assos Santé (qui regroupe les associations de patients) et membre de la commission de la transparence de la HAS. Le laboratoire a alors abandonné sa demande de remboursement. En négociant directement avec la Commission européenne, il a pu imposer le prix de référence américain, qui n’aurait sans doute pas été accepté en France. »
Un total de trente-sept pays
Et de fait, fin juillet, un premier accord est trouvé, pour 30 000 traitements (soit environ 180 000 doses). Coût de l’opération : 63 millions d’euros, soit 2 100 euros par traitement. « Dans l’urgence, ils ont accepté le prix de l’industriel. C’est la première fois dans l’histoire que nous payons un médicament au même prix que les Etats-Unis », constate Jean-Pierre Thierry. Ce montant est directement financé par l’instrument d’aide d’urgence (ESI) de la Commission européenne.
En août et en septembre, la Commission assure deux livraisons aux Etats qui en font la demande, dont la France. Mais ce n’est pas assez. Bientôt, des alertes de pénurie parviennent de différents pays : les Pays-Bas, le Royaume-Uni, la Pologne, l’Italie, l’Espagne. En France, la molécule est peu utilisée : à peine 700 patients ont reçu ce traitement depuis le début de l’épidémie, nous indique Gilead France, soit dans le cadre de l’essai Solidarity, soit dans le cadre de l’ATU (qui a pris fin le 23 octobre).
« Gilead avait énormément de demandes et ne voulait pas signer vingt-sept contrats différents en Europe, raconte, sous couvert d’anonymat, un des responsables des négociations de la Commission européenne. Si nous avions laissé les choses se faire, seuls les gros Etats auraient obtenu des contrats, les autres n’auraient rien eu. »
D’où une nouvelle approche en préparation dès l’été : un contrat-cadre, qui donne accès à un volume donné, à prix fixe. Mais, cette fois, l’argent ne provient pas de la Commission, mais directement des Etats qui achètent ou pas la quantité souhaitée, dans la limite de ce qui peut leur être attribué. Ce contrat commun va au-delà des vingt-sept pays membres, puisqu’il en inclut au total trente-sept, parmi lesquels l’Albanie, la Macédoine du Nord, le Kosovo, la Serbie ou encore la Bosnie-Herzégovine.
C’est lors de la négociation de ce contrat que Gilead reçoit le manuscrit de l’essai clinique Solidarity, durant la deuxième quinzaine de septembre. « L’OMS avait une obligation contractuelle de leur envoyer le manuscrit avant publication, puisque l’essai Solidarity testait leur molécule. Comme c’est généralement le cas, la société avait un temps défini pour faire des retours avant que l’article ne soit soumis pour publication », explique Marie-Paule Kieny, directrice de recherche à l’Inserm et membre du comité exécutif de l’essai Solidarity. Problème : cet essai, durant lequel 2 750 personnes ont pris du remdésivir, ne trouve aucun effet de la molécule, ni sur la mortalité des malades, ni sur leur durée d’hospitalisation.
Coïncidence ? Les quinze jours de révision du manuscrit par Gilead s’achèvent juste après la signature du contrat avec la Commission européenne. Le 7 octobre, la Commission commande ainsi 500 000 traitements (soit trois millions de doses), sans avoir connaissance de ces nouvelles données. « Il y a un problème de transparence si la société Gilead − qui connaissait les résultats − n’a pas signalé à la Commission européenne leur existence », juge Marie-Paule Kieny, qui n’avait pas connaissance des négociations en cours. « Il est aussi regrettable que la Commission n’ait pas pris des renseignements auprès de l’OMS sur l’avancée du plus gros essai clinique mené avec le remdésivir », poursuit la chercheuse française.
« Une énorme pression »
La Commission concède ne pas avoir discuté de ces résultats « avant la publication des essais préliminaires de Solidarity de l’OMS », officiellement accessible le 15 octobre sur la revue en ligne MedRxiv. Quant à Gilead, sa défense consiste en deux points : d’une part, l’essai clinique américain serait « mieux adapté pour évaluer rigoureusement le délai de récupération » que l’essai Solidarity. Et, d’autre part, le contrat « n’oblige ni la Commission européenne ni aucun pays participant à acheter du remdésivir. L’accord permet d’acheter jusqu’à 500 000 traitements, mais les pays contrôlent les quantités qu’ils choisissent d’acheter ».
De fait, le contrat européen n’est assorti d’aucune obligation d’achat. Mais la crainte d’une pénurie a parfaitement fonctionné. Dans certains hôpitaux, « des pharmaciens restaient jusqu’à 3 ou 4 heures du matin pour obtenir une fiole de remdésivir, raconte un haut responsable de santé publique européen. Lorsque, le 8 octobre, Gilead a annoncé que le médicament était largement disponible, les autorités compétentes ont immédiatement passé leur commande. Il y avait une énorme pression pour qu’ils signent ».
Ainsi, dès les jours qui suivent la signature du contrat avec la Commission, de nombreux pays passent commande. Parmi eux, les pays des Balkans, à revenus intermédiaires, qui achètent un médicament dont le prix a été fixé pour… les Etats-Unis. L’accès aux génériques ne leur a pas été autorisé par Gilead, qui a fixé, en mai, une liste de 127 pays qui peuvent en bénéficier. Un peu plus à l’est, l’Ukraine a pu, de son côté, négocier 28 200 doses à un génériqueur pakistanais, fin septembre, au prix de 24,25 dollars la dose (20,45 euros).
Dans cette frénésie, un pays fait exception : la France. Contrairement aux accusations de Didier Raoult, qui parle de « fanatisme pro-Gilead », l’Hexagone est l’un des seuls pays à ne pas avoir passé commande dans le cadre du contrat du 7 octobre (avec le Liechtenstein, qui ne possède pas d’unité de soins intensifs sur son sol, et le Luxembourg, qui a signé mais n’a pas encore passé commande). Néanmoins, plusieurs milliers de doses de remdésivir, allouées précédemment à la France par Gilead et par la Commission européenne dans le cadre de son premier contrat de juillet, seraient encore disponibles pour les hôpitaux qui en feraient la demande auprès de la direction générale de la santé (DGS). Cette dernière n’a jamais répondu à nos sollicitations.
L’avis de la Haute Autorité de santé a sans doute joué dans l’abstention française. Par ailleurs, « l’essai Discovery, qui testait aussi le remdésivir et est rattaché à Solidarity, a d’abord été un essai français avant son extension à l’Europe, rappelle Marie-Paule Kieny. Donc il y a sûrement eu plus d’attention à la prise en compte des résultats scientifiques qu’ailleurs ».
Mais pour les trente-cinq autres pays qui ont déjà signé avec Gilead, il est désormais impossible de renoncer à leur commande, ni de renégocier le prix durant les six prochains mois. D’après notre enquête, au moins 640 000 doses ont déjà été achetées, qui rapportent déjà plus de 220 millions d’euros à Gilead. Des doses qui n’apporteront, en revanche, pas grand-chose aux citoyens.
Cette enquête fait partie du projet européen #BehindthePledge, financé par Journalismfund et IJ4EU. Ludovica Jona (Italie), Hristio Boytchev (Allemagne), Lucien Hordijk (Pays-Bas), Priti Patnaik (Suisse) et Staffan Dahllöf (Danemark) ont également contribué à l’enquête.


Aucun commentaire:
Enregistrer un commentaire