La pharmacovigilance, qui a pour mission de détecter les effets indésirables des traitements médicaux, est en cours de réforme. Les autorités ont dû revoir leur copie, tenant compte des critiques des acteurs de terrain.
Ils sont en première ligne dans la lutte contre les événements indésirables chez les personnes prenant des médicaments. Les pharmacologues médicaux ont l’expertise pour analyser des effets inattendus au regard des connaissances pharmacologiques ou d’une gravité inhabituelle et déterminer s’ils sont imputables au médicament. Peu connus du grand public, ces hospitalo-universitaires des centres régionaux de pharmacovigilance (CRPV), constituent la pierre angulaire de la sécurité du médicament. Et sont souvent sous le feu des critiques lors des crises sanitaires.
Ce fut le cas dans le scandale du Mediator. Pourtant, dès 1999, soit dix ans avant son retrait du marché, le CRPV de Marseille avait remonté à l’Agence nationale de sécurité du médicament (ANSM) un cas d’atteinte des valves cardiaques qu’il suspectait d’être imputable au médicament du laboratoire Servier. Elle n’en avait pas tenu compte. C’est à partir d’un premier signalement par le CRPV de Tours que le Protelos, traitement préventif des fractures dues à l’ostéoporose du même laboratoire, a fini sa carrière en 2017. Celui de Montpellier fut à l’origine du signal sur l’augmentation du risque de cancer de la vessie lié à l’utilisation des antidiabétiques à base de pioglitazone. Ceux-ci furent suspendus en France en 2011 mais laissés sur le marché par l’Agence européenne du médicament avec un ajout dans la notice de contre-indications et de précautions d’emploi.
Dans le dossier de l’antiépileptique Dépakine, où la décision de contre-indiquer ce médicament au cours de la grossesse a été prise en 2010, les risques avaient été évoqués dès 2004-2005 au sein du comité technique de pharmacovigilance, qui réunit tous les centres, à l’occasion de quatre cas marquants. « Deux de ces cas ont été transmis au groupe de travail “Grossesse et allaitement” [de l’ANSM], sans suites connues au vu des comptes rendus », constatait en 2015 le rapport de l’Inspection générale des affaires sociales.
Dans une tribune publiée le 24 avril dans Le Monde, des responsables de ces centres s’étaient alarmés du projet de décret – qui leur était présenté après deux ans de discussions avec le ministère de la santé – prévoyant de réformer l’ensemble de la vigilance sur les produits de santé. Ils y voyaient « un risque de dérive vers un système trop administratif ou trop territorialisé » et invitaient les pouvoirs publics à « mesurer le risque qu’il y aurait à déstructurer le réseau des CRPV ».
Préserver l’expertise des CRPV
L’ANSM a en charge sept vigilances sanitaires : la pharmacovigilance (pour les médicaments), l’addictovigilance (substances psychoactives, médicaments ou stupéfiants), l’hémovigilance (produits sanguins), la matériovigilance (dispositifs médicaux), la réactovigilance (dispositifs de diagnostic in vitro), la cosmétovigilance (cosmétiques) et la vigilance sur les produits de tatouage. La biovigilance (activité de greffe) dépend depuis 2016 de l’Agence de biomédecine.
« La première version du décret était trop abrupte, et nous ne l’avions pas assez expliquée aux pharmacovigilants. » Thierry Paux, sous-directeur de la veille et sécurité sanitaire de la DGS
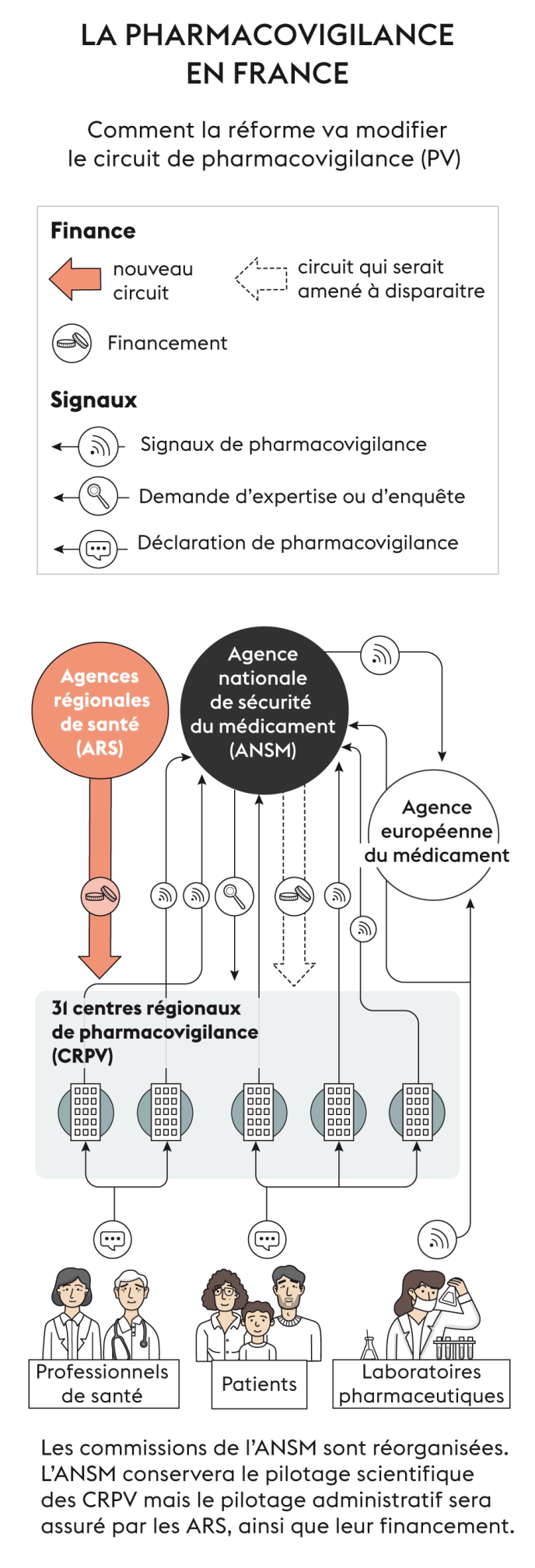
Pour le ministère de la santé, il s’agit d’améliorer la lisibilité du dispositif de vigilance et d’en renforcer l’efficience. Dans le droit-fil de la loi de modernisation du système de santé de 2016, qui confie aux agences régionales de santé (ARS) l’organisation des vigilances sur tout le territoire, et de la stratégie nationale de santé 2018-2022, qui vise à une meilleure adaptation à la détection des signaux faibles et des alertes, le ministère de la santé avait préparé un projet de décret et un arrêté devant prendre effet en janvier 2020.
Devant l’inquiétude manifestée par les spécialistes, ceux de la pharmacovigilance et de l’addictovigilance en tête, la ministre de la santé a demandé à la Direction générale de la santé (DGS) de revoir la copie. « La première version du décret était trop abrupte, et nous ne l’avions pas assez expliquée aux pharmacovigilants, reconnaît Thierry Paux, sous-directeur de la veille et sécurité sanitaire de la DGS. Le nouveau texte maintient la compétence et l’expertise propres des professionnels des vigilances, et renforce les centres et la coordination régionale, l’ANSM assurant la coordination au niveau national. » Une version quasi définitive sera proposée cette semaine.
« L’autre grand changement sera le passage de la gestion, sur certains objectifs fixés, des mains de l’ANSM à celles des ARS, souligne le directeur général de l’ANSM, Dominique Martin. En revanche, les informations concernant les produits de santé continueront à remonter directement des CRPV à l’ANSM. Nous continuerons à préserver l’expertise indispensable des CRPV, qui possèdent la compétence clinique sur l’imputabilité à un médicament des effets indésirables signalés. » Le projet comporte aussi un plafonnement des frais de fonctionnement que les CHU prélèvent sur le budget des CRPV : alors qu’ils atteignent parfois 30 %, voire 40 %, ils ne pourraient plus dépasser 7 %.
« Dans sa version actuelle, le décret va dans le bon sens, car il maintient nos spécificités et nos missions essentielles. De plus, le courrier que nous a adressé la ministre de la santé est rassurant, car elle y exprime son attachement aux centres de pharmaco et d’addictovigilance », souligne Régis Bordet, du CRPV de Lille. Un soulagement donc, mais pas complet. « Nous restons vigilants sur quatre points, précise-t-il. D’abord, il s’agit de maintenir notre maillage territorial, avec des structures fortes. Ensuite, même si nous sommes pilotés au niveau régional par les ARS, il nous faut conserver un fonctionnement en réseau national. Il est important, notamment, que les 31 centres puissent échanger, par le biais de nos interactions avec l’ANSM, car cela contribue à donner du poids aux signaux. » Le troisième point est celui de la maîtrise des financements. Enfin, « il ne faudrait pas que les évolutions technologiques nous fassent perdre l’expertise médicale et scientifique des dossiers qui nous permet de transformer les cas en signaux d’alerte », estime le professeur Bordet.
Ces professionnels s’inquiètent en particulier de la future connexion de la base nationale de pharmacovigilance avec le portail des signalements, inscrite au programme de travail de l’ANSM pour 2020. Un point apparemment très technique mais qui pourrait, selon ces spécialistes, profondément modifier le circuit de surveillance.
Aujourd’hui, la mission première des CRPV est de travailler sur des cas individuels de « maladies médicamenteuses », à partir de questions – posées par des professionnels de santé ou des patients –, et des déclarations d’effets indésirables parvenant notamment sur le site Signalement-sante. gouv. fr. Chaque cas est analysé, puis enregistré dans la base nationale de pharmacovigilance. Ceux qui sont dits « marquants », du fait de leur gravité ou de leur nouveauté, sont signalés spécifiquement à l’ANSM. L’agence peut alors demander un rapport d’expertise sur le sujet à un CRPV – souvent celui qui a remonté le cas marquant – pour confirmer le signal et proposer des mesures de réduction du risque : information aux professionnels et au public, précautions d’emploi, restrictions d’utilisation, voire suspension du médicament… Des décisions prises, selon les cas, à l’échelle nationale ou, le plus souvent, à présent, européenne.
Un déficit de communication
« La future connexion des deux bases peut être un gain de temps pour les cas très simples déclarés par les patients. Pour les autres cas, cette stratégie relève d’une méconnaissance de notre travail, qui consiste à compléter et expertiser les données afin de leur donner du sens pour la saisie, estime la docteure Annie-Pierre Jonville-Béra, présidente de l’association des CRPV et responsable du CRPV Centre-Val de Loire (CHU de Tours). De plus, 15 % des cas font suite à une question posée au centre, et non à une déclaration. »
« L’objectif de la pharmacovigilance, ce sont les signaux, donc les cas graves ou nouveaux. Et c’est souvent des professionnels de santé qu’ils proviennent. » Annie-Pierre Jonville-Béra, responsable du CRPV Centre-Val de Loire
Les responsables des centres sont aussi sceptiques sur l’intérêt de faciliter à outrance les déclarations directes par les usagers. A chaque crise sanitaire ou presque, la sous-déclaration des effets indésirables est mise en évidence et présentée comme un point faible de la pharmacovigilance. Un faux débat, selon la docteure Jonville-Béra. « L’exhaustivité ne sert à rien, assure-t-elle. Si on veut connaître l’incidence d’un effet indésirable, la bonne méthode est une enquête de pharmacoépidémiologie. L’objectif de la pharmacovigilance, ce sont les signaux, donc les cas graves ou nouveaux. Et c’est souvent des professionnels de santé qu’ils proviennent. »
Dans le cas du Levothyrox, l’afflux de déclarations directes sur le portail (33 000 au total en 2017 en France) a généré un surcroît énorme de travail pour les équipes, mais peu de données pertinentes pour l’enquête, estime la présidente de l’association des CRPV. « Le signal était remonté très tôt et le portail a servi de caisse de résonance, mais beaucoup de déclarations n’étaient pas réellement des cas. Sur les 800 déclarations analysées à Tours, aucune ne correspondait à un effet indésirable grave. »
Les pharmacovigilants s’interrogent également sur la réorganisation des commissions de l’ANSM, qui ne relève que de l’agence, avec la disparition des comités techniques, où tous les centres étaient présents, au bénéfice de réunions auxquelles seuls certains participeront. Une architecture qui selon eux risque de nuire à la diffusion rapide et homogène des informations au sein des régions, d’autant plus préjudiciable en cas de crise sanitaire.
De leur côté, les associations de patients se réjouissent d’être représentées dans tous les futurs comités permanents de l’ANSM (quinze en tout, portant sur des vigilances mais aussi des pathologies). « Avec cette nouvelle organisation, nous espérons être davantage associés aux décisions, mais nous restons très attentifs car ces comités ne sont que consultatifs », indique Yann Mazens, chargé de mission produits et technologies de santé à France Assos Santé, qui représente 80 associations de patients.
Comme les pharmacovigilants, mais pour des raisons différentes, il est lui aussi réservé sur l’incitation au signalement par les patients d’événements indésirables sur le portail du ministère. « Désormais, à chaque crise sanitaire, les usagers sont invités à faire des déclarations ; mais à quoi sert cette démarche s’il n’y a pas d’accompagnement concret ensuite ? », s’interroge M. Mazens. Selon lui, la réforme ne va pas contribuer à résoudre l’une des faiblesses majeures du système actuel : la communication. « En cas d’alerte sanitaire, les patients sont d’abord informés par les médias et les réseaux sociaux. Les autorités sont encore réticentes à communiquer précocement, ce qui est particulièrement inapproprié pour établir une confiance à l’heure où les informations circulent très rapidement », regrette le représentant de France Assos Santé.
Une faille gênante
Autre sujet de préoccupation pour la structure : en cas de risque avéré avec un médicament ou un implant médical, il n’y a actuellement pas de possibilité de contacter des patients sortis des soins depuis plus de deux ans. Le système en place repose sur les données de remboursement de l’Assurance-maladie, dont la durée de conservation est limitée. Une faille d’autant plus gênante que des effets indésirables peuvent se révéler longtemps après un traitement médicamenteux ou la pose d’une prothèse.
Ainsi, le risque de méningiome lié à l’Androcur (un traitement hormonal) a fait l’objet d’une alerte en juin 2018, mais les personnes concernées sorties du soin n’ont toujours pas été informées, déplore Yann Mazens. « Pourtant, il y aurait là intérêt à communiquer. Le risque étant faible, cela permettrait de rassurer beaucoup de personnes paniquées par manque d’information », dit-il.
Pour remédier à cette situation, France Assos Santé demande que la future plate-forme des données de santé, le « health data hub » bénéficie directement aux usagers en permettant de contacter l’ensemble des individus – pas seulement ceux affiliés au régime général – sur une durée de vingt ans.
La disponibilité de grandes bases de données soulève la question de la place de l’intelligence artificielle (IA) dans les vigilances sanitaires. « Aujourd’hui, on peut faire de la détection d’événements indésirables sur les forums ou sur Twitter, mais on n’en est pas au stade où on peut tout chambouler », estime Clément Goehrs, PDG de Synapse Medicine, un assistant virtuel à base d’IA pour aider à mieux prescrire les médicaments.
Pour ce jeune médecin formé en santé publique, il faut réfléchir à améliorer le système de pharmacovigilance, mais le bon usage du médicament est un sujet très complexe, et l’expertise doit rester humaine. « Le danger serait d’aller vers quelque chose de très administratif et de penser qu’on va tout régler avec le big data. Moi qui en traite beaucoup, je sais que toute la vérité n’est pas dans la donnée, c’est souvent biaisé et difficile à analyser », insiste-t-il.





Aucun commentaire:
Enregistrer un commentaire