Par Chloé Aeberhardt Publié le 23 janvier 2021
Les fabricants de vaccins sont contraints par des tensions d’approvisionnement en matières premières et par les limites de l’outil industriel.
Optimiser les doses, jusqu’à la dernière goutte. Voilà à quoi en sont réduits les pays européens, dont la lutte contre le Covid-19 dépend de l’accès aux deux seuls vaccins pour l’instant autorisés dans l’Union européenne (UE), ceux de Moderna et de Pfizer-BioNTech. Les fabricants ont beau avoir augmenté leurs objectifs pour 2021 (1 milliard de doses pour Moderna, environ 2 milliards pour Pfizer-BioNTech), le rythme de production n’est pas assez soutenu pour répondre à l’urgence. Dans un entretien au Spiegel publié début janvier, le cofondateur de BioNTech Ugur Sahin reconnaissait déjà que la situation n’était « pas rose ». « Faute de nouveaux vaccins autorisés, il y a un manque que nous devons combler. »
Le ciel ne s’est pas éclairci depuis. Au contraire, deux vives controverses ont été provoquées par Pfizer et BioNTech, à qui l’UE a commandé 600 millions de doses. Le 15 janvier, les laboratoires signalaient des retards de livraison en raison d’aléas dans la production ; cette semaine, ils indiquaient que l’Agence européenne des médicaments (EMA) ayant établi qu’un flacon de leur vaccin contenait six doses, et non cinq comme initialement annoncé, ils livreraient moins de flacons pour le même prix. Or, prélever cette sixième dose nécessite un geste spécifique et un matériel adapté qui n’est pas celui dont les soignants sont équipés de manière standard… En attendant l’arrivée du vaccin d’AstraZeneca, qui pourrait être autorisé par l’EMA le 29 janvier, les Européens n’ont pas d’autre choix que de vacciner au rythme de la production des deux vaccins à ARN messager, dont la montée en cadence représente un défi industriel sans précédent.
Est-ce difficile de fabriquer un vaccin à ARN messager ?
Contrairement aux vaccins qui utilisent des virus ou des protéines pour véhiculer l’antigène, les vaccins à ARN messager donnent des instructions aux cellules pour qu’elles produisent elles-mêmes la protéine du virus qui déclenchera une réponse immunitaire. Cette méthode permet de produire des vaccins rapidement, l’organisme des patients prenant en charge une partie du travail habituellement réalisé en laboratoire. Elle est aussi plus facile à mettre en œuvre. « Les vaccins traditionnels nécessitent de larges installations pour la production des virus ou des protéines, explique Steve Pascolo, chercheur à l’hôpital de Zurich et cofondateur du laboratoire CureVac (dont le vaccin à ARN messager est en essais cliniques de phase 3). Ces agents doivent ensuite être purifiés avec délicatesse, pour ne pas les endommager. En comparaison, les vaccins à ARN messager requièrent moins de matériel et de manipulation. » La substance active s’obtenant en très forte quantité dans un volume réduit, la production (ou « transcription ») de l’ARN messager se fait dans des incubateurs relativement petits. Quant à la purification, elle est simple, l’ARN étant à ce stade plutôt résistant.
Sur le papier, cette technologie est tout à fait adaptée à une production de masse. En pratique, le rendement global est limité car « les unités de production restent à créer », rappelle Anne Bucher, l’ancienne directrice générale de la santé de la Commission européenne (jusqu’en octobre 2020), qui a rédigé pour le think tank Terra Nova une note consacrée à la production de vaccins publiée le vendredi 22 janvier. Les vaccins de Pfizer-BioNTech et Moderna étant les premiers médicaments à ARN messager approuvés pour l’homme, les infrastructures existantes étaient jusqu’ici réservées à une production modeste consacrée à la recherche clinique et au développement de futurs vaccins et thérapies contre des cancers ou des maladies rares.
Les fabricants manquent-ils de matières premières ?
Pour fabriquer leur vaccin, Pfizer-BioNTech et Moderna ont besoin d’enzymes, de nucléotides et de nanoparticules lipidiques (NPL). Des matières premières qui, jusqu’en 2020, n’étaient pas produites à grande échelle. « Les NPL ont longtemps été une niche assez exotique, très peu d’entreprises en produisent », reconnaît Dietmar Katinger, le PDG de l’entreprise autrichienne Polymun Scientific, qui fournit ces particules pour BioNTech. Les fabricants de vaccins diversifient les sources d’approvisionnement, sans toujours parvenir à sécuriser leurs besoins. Ainsi confie-t-on chez Moderna : « Nous prévoyons de livrer entre 600 millions et 1 milliard de doses au cours de l’exercice 2021. Ce chiffre peut toutefois être influencé par le rendement et la disponibilité des matières premières. »
Pour assurer les commandes, Polymun a acheté des équipements, embauché, réservé un laboratoire supplémentaire à la production de NPL. « Mais il est évident que nous ne pourrons pas répondre seuls à l’énorme demande. C’est pourquoi nous avons passé des accords de transferts de savoir-faire avec d’autres fabricants. » Du côté des enzymes et des nucléotides, la demande allait déjà croissant avant 2020. « Juste avant l’épidémie, nous avons mis en service une installation de pointe pour faire face à l’augmentation prévue de la demande en ARN thérapeutiques », se félicite-t-on chez New England Biolabs, qui fournit notamment BioNTech. Grâce à cet investissement, l’entreprise américaine a pu honorer toutes ses commandes. Mais cela risque de ne pas suffire : « Nous continuons de chercher de nouvelles, ou meilleures solutions, pour répondre aux besoins mondiaux. »
Comment s’organise la montée en cadence ?
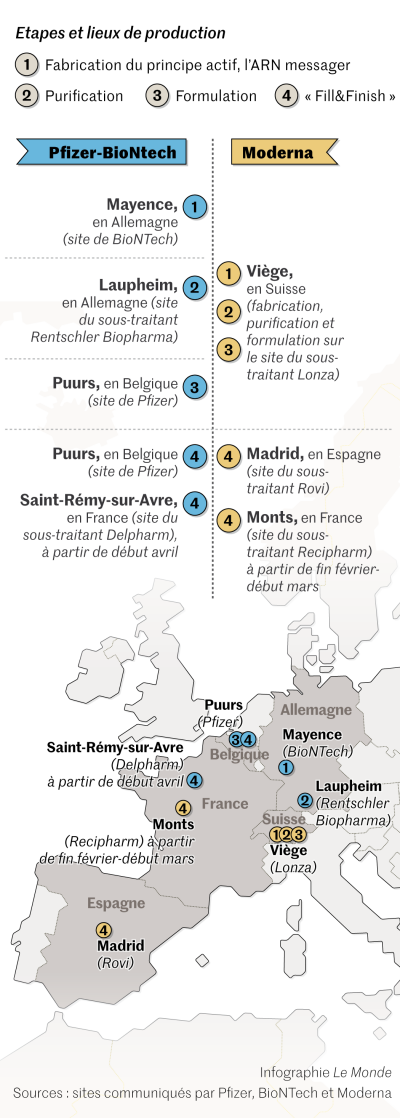
Le cas de figure est différent selon que l’on parle de Moderna, une start-up qui s’est lancée seule dans la course, ou de BioNTech, qui a préféré s’associer au géant Pfizer, un spécialiste des vaccins. Tandis que l’alliance germano-américaine a les capacités suffisantes pour garder la production du principe actif en « interne », Moderna la sous-traite pour l’Europe au façonnier suisse Lonza. Démarrée en novembre 2020, la fabrication a lieu à Viège, sur un site équipé d’unités de production capables de s’adapter à n’importe quelle technologie. « Grâce à ces installations, nous avons été prêts en moins de huit mois, contre deux ans s’il avait fallu construire une infrastructure à partir de zéro », précise Andre Goerke, qui dirige le projet Moderna pour Lonza. Le façonnier travaille actuellement à l’augmentation des cadences de trois de ses quatre lignes de production, dont le rendement est évalué pour chacune à environ 100 millions de doses par an.
Du côté de Pfizer et BioNTech, la montée en puissance concerne d’abord les capacités de production maison. Les retards de livraison accusés cette semaine seraient ainsi dus à des « ajustements » sur l’usine belge de Puurs, dont Pfizer refuse de préciser la nature. « Peut-être qu’une ligne a été arrêtée le temps de remplacer un équipement par un autre au rendement plus élevé ? », imagine un industriel du secteur qui préfère rester anonyme. Même absence de détails concernant le site allemand de Marbourg, qui sera mis en service en février. Racheté par BioNTech à Novartis, il devrait permettre d’augmenter la capacité de production de 750 millions de doses par an. Mais, comme le rappelle Anne Bucher, « la construction de nouveaux sites est plutôt l’exception », le recours à la sous-traitance offrant « beaucoup de flexibilité ».
Sanofi va-t-il effectuer de la sous-traitance pour d’autres laboratoires ?
Pour aider les fabricants à tenir leurs engagements, Bercy a dès cet été recensé tous les sous-traitants habilités à réaliser certaines étapes de fabrication sur le territoire français. Depuis, Moderna et Pfizer-BioNTech ont respectivement fait appel à Recipharm et Delpharm pour le conditionnement (« Fill & Finish ») de leurs flacons, qui devrait commencer d’ici quelques semaines. Mais les volumes sont tels que les prestataires seront sans doute contraints de prioriser les lignes réservées au vaccin au détriment des autres. « Dans le secteur, tous les acteurs sont au maximum de leurs capacités, et pourtant les doses produites ne sont pas suffisantes », regrette Stéphane Lepeu, directeur général délégué de Delpharm.
Pour compléter l’offre, et augmenter les capacités de production, « la ministre déléguée à l’industrie, Agnès Pannier-Runacher, a fait la demande à Sanofi, au nom de la France », de mettre son outil industriel à disposition de ses concurrents les plus avancés, dit-on à Bercy. Le groupe français, qui développe un vaccin avec GSK, a annoncé le 11 décembre qu’à la suite d’une erreur de laboratoire, ses essais cliniques accuseraient un retard de plusieurs mois. « Si nous pouvons aider, nous le ferons », assure-t-on chez Sanofi, qui d’après Bercy étudie la faisabilité technique d’un transfert d’activité de « Fill & Finish » des vaccins de Pfizer-BioNTech ou Johnson & Johnson. « Nous sommes en train de chercher des lignes qui ne tourneraient pas à 100 %, ou dont nous pourrions diminuer un peu l’activité. Si un accord était trouvé, il faudrait tout de même compter plusieurs semaines », détaille-t-on chez Sanofi. A titre de comparaison, il faudra plus de quatre mois à Delpharm pour se préparer au conditionnement du vaccin à – 70 °C de Pfizer-BioNTech, dont les caractéristiques particulières ont conduit l’entreprise à investir dans une cuve spécifique et 55 congélateurs.
Le vaccin d’AstraZeneca peut-il changer la donne ?
Le 29 janvier, l’EMA pourrait donner son feu vert à l’autorisation du vaccin développé par le laboratoire anglo-suédois et l’université d’Oxford. C’est peu de dire que cette décision est attendue. Non seulement ce vaccin est facilement transportable (il se conserve entre 2 et 8 °C) et vendu à prix coûtant toute la durée de l’épidémie (environ 2 euros la dose, soit 4 euros par patient), mais il devrait être produit en énorme quantité : le laboratoire a sécurisé une capacité de production mondiale de 3 milliards de doses pour 2021. « Plus d’une douzaine de chaînes d’approvisionnement ont été mises en place pour respecter cet engagement », explique-t-on chez AstraZeneca.
Comme les chinois CanSino et Sinovac, le laboratoire a par ailleurs fait le choix de passer des accords de transferts de technologie avec des pays industrialisés comme le Brésil, l’Inde ou le Mexique, qui peuvent ainsi consolider leur base industrielle et acquérir du savoir-faire. Malheureusement, le laboratoire a déclaré vendredi 22 janvier qu’« en raison d’une baisse de rendements » sur un site de production, les premières livraisons réservées à l’UE seraient moins importantes que prévu – 31 millions de doses d’ici à fin mars, au lieu de 80 millions, soit une baisse de 60 %, selon Reuters. « Nous fournirons des dizaines de millions de doses à l’Union européenne en février et mars tout en continuant la montée en charge de notre appareil productif », a tenté de rassurer AstraZeneca. Peine perdue. La commissaire européenne à la santé, Stella Kyriakides, a immédiatement évoqué sur Twitter son « profond mécontentement ». La décision du 29 janvier n’est pas encore rendue que l’espoir est déjà déçu.




Aucun commentaire:
Enregistrer un commentaire