Par Sandrine Cabut et Audrey Lagadec Publié le 17 mai 2022
La survie à deux mois de David Bennett, premier transplanté avec un cœur porcin génétiquement modifié, est considérée comme un pas important sur la route des xénotransplantations, commencée il y a plus d’un siècle.
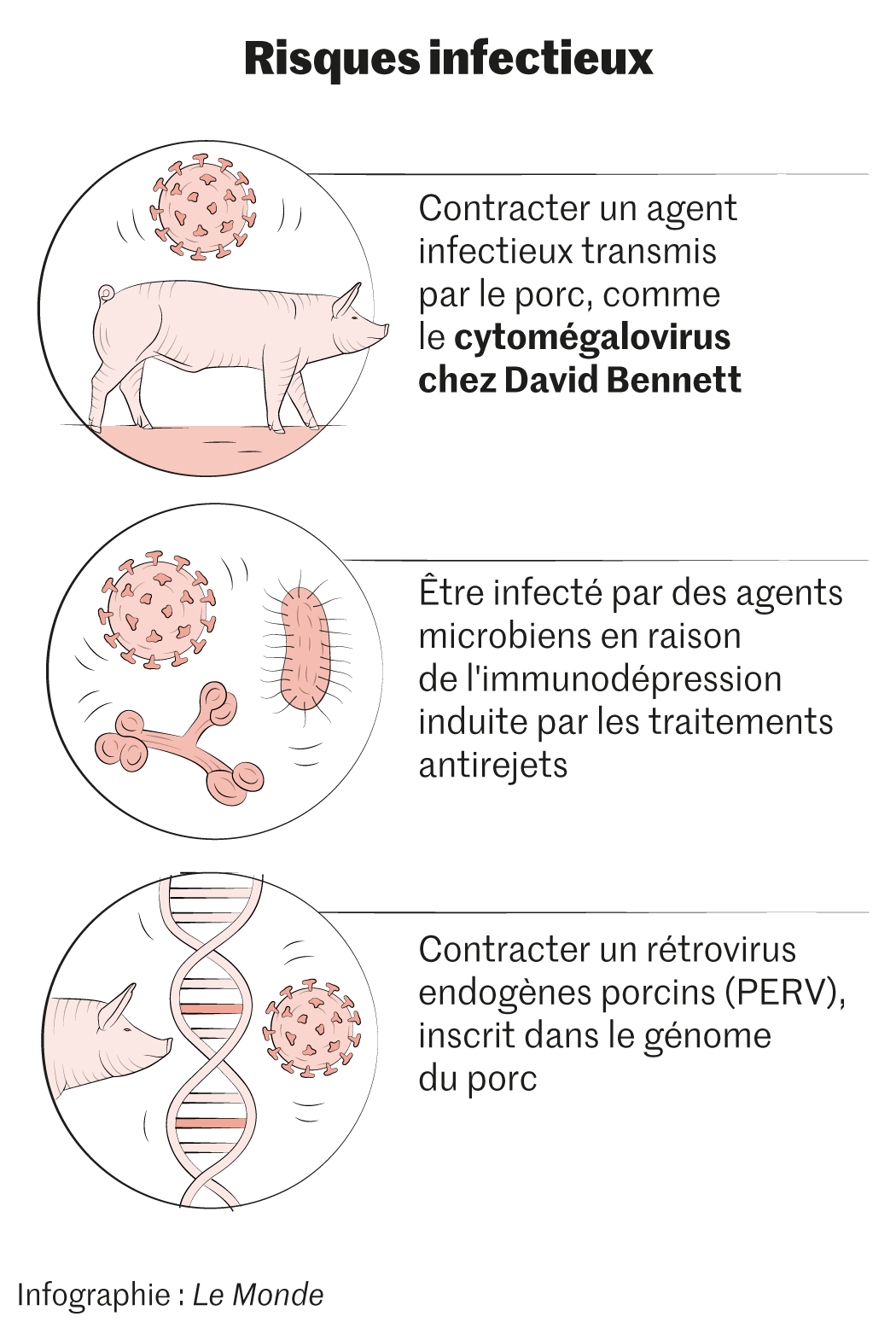
David Bennett, premier homme au monde à avoir été transplanté du cœur à partir d’un organe de porc génétiquement modifié, est-il décédé à la suite d’une infection virale transmise par l’animal donneur ? De l’ADN d’un cytomégalovirus (CMV) porcin a été retrouvé dans le sang de cet Américain de 57 ans, a annoncé, lors d’un congrès américain sur la transplantation, le docteur Bartley Griffith (hôpital universitaire du Maryland), l’un des chirurgiens qui avaient réalisé l’intervention chirurgicale, le 7 janvier. L’information, qui n’a pas encore fait l’objet d’une publication scientifique, a été révélée le 4 mai dans la revue MIT Technology Review, puis reprise dans un long article du New York Times.
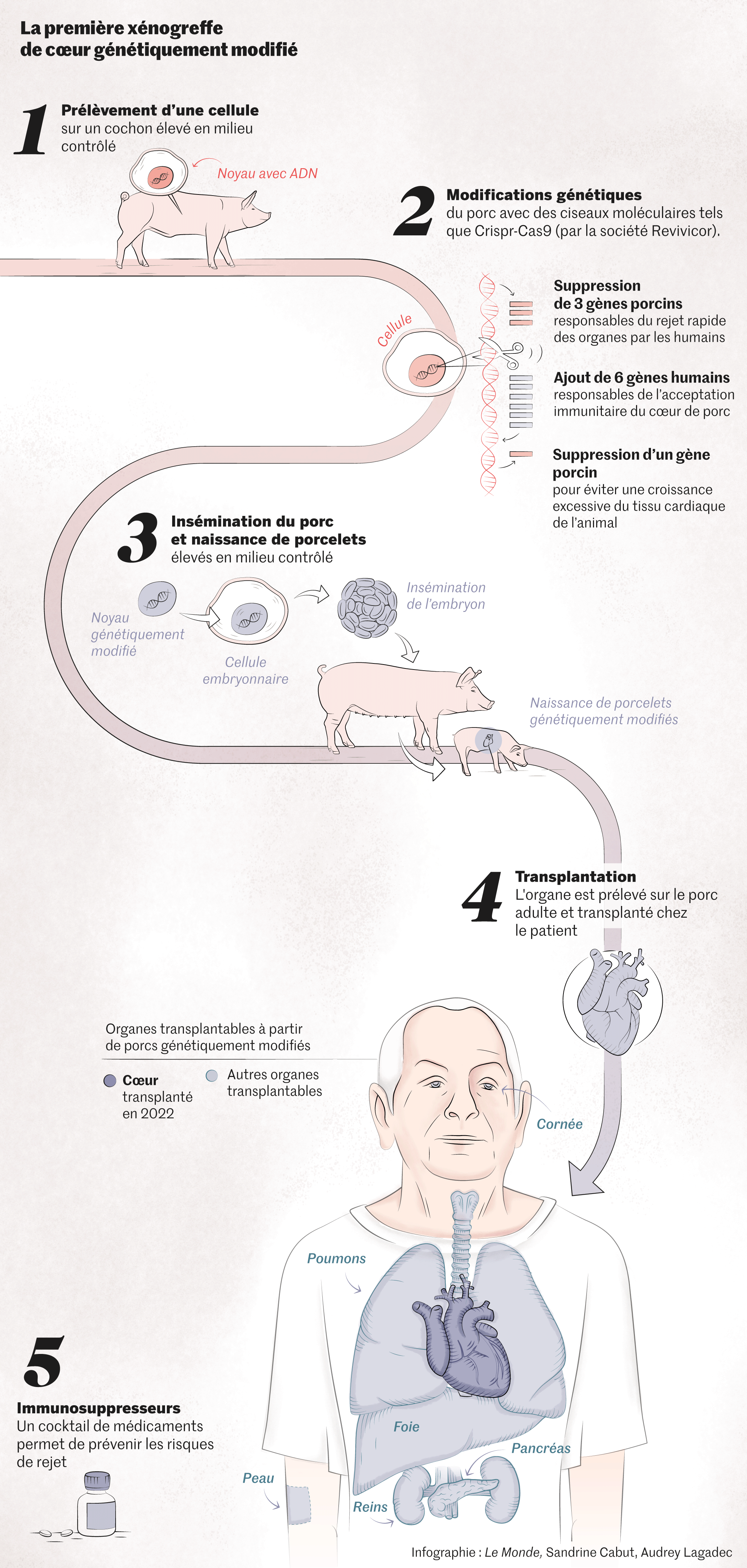
Atteint d’une insuffisance cardiaque terminale et inéligible à une transplantation conventionnelle, David Bennett a reçu à titre compassionnel un cœur de porc génétiquement modifié. Le recours à des techniques d’édition du génome (tel Crispr-Cas9, mis au point en 2012 par la Française Emmanuelle Charpentier et l’Américaine Jennifer Doudna) permet de modifier génétiquement l’animal donneur, pour prévenir les rejets, voire certains risques infectieux, principales causes d’échec des greffes entre espèces.
Chèvres, lapins, singes (chimpanzés, babouins)… Depuis un siècle, diverses espèces animales ont été utilisées comme sources d’organes. Progressivement, le porc est apparu comme le plus approprié, notamment parce que son anatomie est assez proche de celle de l’homme, qu’il est relativement facile à élever et que sa croissance est rapide. Le rendement reste toutefois modeste : « Sur 100 porcs génétiquement modifiés, seul un est utilisable », précise le professeur Olivier Bastien, ancien directeur des prélèvements et des greffes à l’Agence de la biomédecine (ABM).
L’organe a initialement bien fonctionné, et cette première en matière de xénotransplantation, avec un cœur porcin modifié au niveau d’une dizaine de gènes par une technique d’édition du génome, a été saluée dans le monde entier.
Selon la presse américaine, des traces de CMV porcin ont d’abord été mises en évidence chez le patient lors d’un prélèvement vingt jours après l’intervention. Mais les niveaux étaient si faibles que l’équipe médicale – qui a reçu les résultats dix jours plus tard – a alors cru à une erreur, d’autant que le porc était a priori contrôlé et jugé non porteur de ce germe. Quand l’état de David Bennett s’est dégradé, après une quarantaine de jours, la concentration en CMV porcin était nettement plus élevée et un traitement antiviral et par immunoglobulines a été commencé. L’Américain est finalement décédé le 8 mars. Le virus a aussi été détecté dans la rate du porc donneur.
Le rôle précis du CMV porcin dans la dégradation de l’état clinique du patient et son décès font débat. « Il n’est pas prouvé qu’il y ait eu une infection active due à ce virus ou un rejet du cœur transplanté », a indiqué le docteur Bartley Griffith au NY Times.
Les risques des cytomégalovirus humains, pour les patients immunodéprimés et en particulier les transplantés, sont en revanche bien connus. « Pour les prévenir, les greffés reçoivent systématiquement un traitement antiviral pendant plusieurs mois », souligne Olivier Bastien.
Par ailleurs, tous les porcs ont des rétrovirus endogènes porcins (PERV) dans leur génome, ce qui peut être une autre source d’infection pour le receveur d’une xénotransplantation. En 2017, l’équipe du généticien américain George Church, de l’université Harvard, a réussi à bloquer l’expression de ces virus endogènes avec la technique d’édition du génome Crispr-Cas9, ce qui constitue une avancée majeure, selon Olivier Bastien. « Actuellement, cela fonctionne bien sur les PERV. Nous travaillons sur une méthode spécifique pour les cytomégalovirus et plus globalement sur tous les virus », indique au Monde le généticien d’Harvard. Son équipe mène des essais précliniques de xénogreffes chez des primates dans trois hôpitaux, précise-t-il.
Malgré l’issue fatale au bout de deux mois chez David Bennett, cette première greffe de cœur porcin génétiquement modifié est considérée comme un pas important sur la longue route des xénotransplantations, commencée il y a plus d’un siècle.
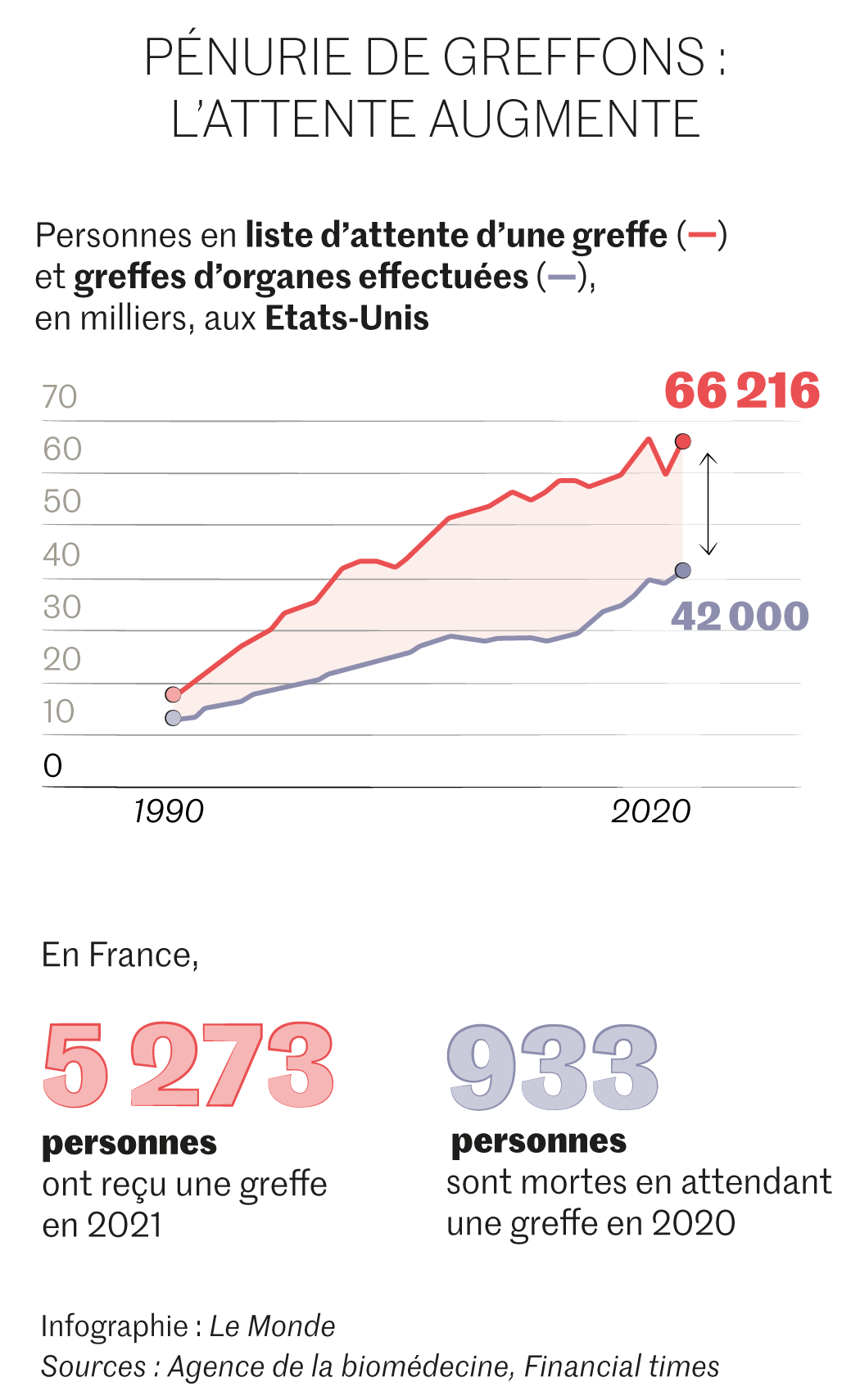
Face à la pénurie croissante d’organes humains, les xénogreffes apparaissent comme une alternative bienvenue. Les recherches sont particulièrement actives aux Etats-Unis et en Chine, mais de nombreux défis restent à résoudre.
Avec les risques infectieux, le principal écueil est le rejet de l’organe transplanté, qui peut survenir de façon hyperaiguë lors d’une greffe entre espèces. Comme les greffes entre humains, les xénogreffes ont bénéficié des progrès des traitements immunosuppresseurs, nés à la fin des années 1950 et de plus en plus performants. Les modifications du génome de l’animal donneur avec des techniques comme Crispr-Cas9 sont une autre voie pour réduire les risques de rejet.



Aucun commentaire:
Enregistrer un commentaire